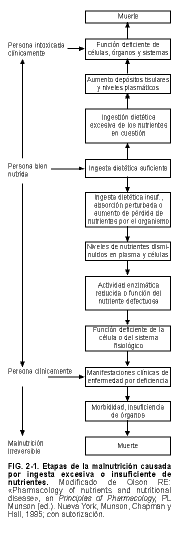
2 / MALNUTRICIÓN
La malnutrición es el resultado del desequilibrio entre las necesidades del organismo y la ingesta de nutrientes, lo que puede conducir a síndromes de deficiencia, dependencia, toxicidad u obesidad. La malnutrición comprende la hiponutrición, en la que los nutrientes se aportan escasamente, y la hipernutrición, en la cual los nutrientes se ofertan con exceso. La hiponutrición puede ser resultado de ingesta insuficiente, malabsorción, pérdida sistémica anormal de nutrientes debida a diarrea, hemorragia, insuficiencia renal o sudoración excesiva, infección o adicción a fármacos. La hipernutrición puede ser consecuencia de comer en exceso, insuficiencia de ejercicio, prescripción excesiva de dietas terapéuticas, incluida la nutrición parenteral, ingesta excesiva de vitaminas, en particular piridoxina (vitamina B6), niacina y vitaminas A y D e ingesta excesiva de oligoelementos. Véanse también los comentarios sobre obesidad en el capítulo 5; deficiencia y toxicidad vitamínica y mineral en los caps. 3 y 4, y las alteraciones del apetito en el capítulo 196.
La malnutrición (hiponutrición e hipernutrición) se desarrolla en etapas, lo cual suele requerir mucho tiempo. En primer lugar se alteran los niveles de nutrientes en sangre y/o tejidos, seguido por cambios intracelulares en las funciones y la estructura bioquímicas. Con el tiempo se presentan signos y síntomas; puede producirse morbididad y mortalidad (v. fig. 2-1).

Detección temprana
La clave de la detección temprana es el conocimiento de qué personas tienen un alto riesgo de hiponutrición en ciertas circunstancias (v. tabla 2-1) o de hipernutrición (v. tabla 2-2). La hiponutrición se asocia con la pobreza y la privación, ocurre entre los pobres, incluidos algunos inmigrantes que llegan de países en vías de desarrollo. El riesgo de hiponutrición es además mayor en ciertas épocas de la vida de la persona, por ejemplo, lactancia, niñez temprana, adolescencia, embarazo y lactancia y edad avanzada. La hipernutrición está asociada con un estilo de vida sedentario y con la disponibilidad continua de alimento en los países más prósperos.

Pueden estar en riesgo de malnutrición las personas que se encuentran en las siguientes circunstancias:
Lactancia y niñez: Debido a la alta demanda de energía y nutrientes esenciales, los lactantes y los niños pequeños tienen un riesgo especial de hiponutrición. La malnutrición proteicoenergética en niños que consumen cantidades insuficientes de proteínas, calorías y otros nutrientes es una forma de hiponutrición particularmente grave que retarda el crecimiento y el desarrollo (v. más adelante). La enfermedad hemorrágica del recién nacido, un trastorno que amenaza la vida, se debe a insuficiencia de vitamina K (v. Deficiencia de vitamina K, cap. 3). Los lactantes y niños insuficientemente alimentados pueden padecer deficiencia de hierro, ácido fólico, vitamina C, cobre, cinc y vitamina A. En la adolescencia, las necesidades nutricionales aumentan a causa del aumento de ritmo del crecimiento. La anorexia nerviosa, una forma de inanición, puede afectar a niñas adolescentes (v. cap. 196).
Embarazo y lactancia: Las necesidades de todos los nutrientes están aumentadas en el embarazo y la lactancia. Aberraciones de la dieta, como la pica (el consumo de sustancias no nutritivas, como tiza y carbón), son frecuentes en el embarazo (v. Anemia por deficiencia de hierro, cap. 127). La anemia debida a deficiencia de ácido fólico es común en mujeres gestantes, especialmente en las que han tomado anticonceptivos orales. Actualmente se recomiendan suplementos de ácido fólico a las mujeres embarazadas para prevenir defectos del tubo neural (espina bífida) en sus hijos. Un lactante criado exclusivamente con lactancia materna puede desarrollar una deficiencia de vitamina B12 si la madre es vegetariana estricta. Una madre alcohólica puede tener un niño minusválido y desmedrado con síndrome alcohólico fetal, que se debe a los efectos del etanol y la malnutrición sobre el desarrollo fetal (v. Síndrome
alcohólico fetal, cap. 260).
Edad avanzada: Un sentido del gusto y el olfato deprimido, la soledad, la incapacidad física y mental, la inmovilidad y las afecciones crónicas favorecen una ingesta dietética insuficiente en los ancianos. La absorción se reduce, contribuyendo tal vez a producir deficiencia de hierro, osteoporosis (también relacionada con la deficiencia de calcio) y osteomalacia debida a carencia de vitamina D y a ausencia de exposición a la luz solar (v. Deficiencia y dependencia de vitamina D, cap. 3).
Al envejecer -con independencia de que exista enfermedad o deficiencia dietética- existe una pérdida progresiva de masa corporal magra, que asciende a unos 10 kg en hombres y 5 kg en mujeres. Esto explica la disminución del IMC, el peso corporal total, la masa esquelética y la estatura, y un aumento de la grasa corporal media (expresada en porcentaje del peso corporal) de un 20 a un 30% en hombres y de un 27 a un 40% en mujeres. Estos cambios y la reducción de la actividad física conducen a que las necesidades de energía y proteínas sean inferiores, comparadas con las de los adultos más jóvenes.
Enfermedad crónica: En los Pacientes con enfermedades crónicas, los estados de malabsorción (incluidos los resultantes de la cirugía) tienden a dificultar la absorción de vitaminas liposolubles, vitamina B12, calcio y hierro. Las hepatopatías alteran el almacenamiento de vitaminas A y B12 e interfieren el metabolismo de las fuentes proteicas y energéticas. Los Pacientes con nefropatías, incluidos los sometidos a diálisis, son propensos a desarrollar deficiencias de proteínas, hierro y vitamina D. Algunos Pacientes con cáncer y muchos Pacientes con SIDA tienen anorexia, lo que complica el tratamiento. En los Pacientes que reciben nutrición parenteral prolongada domiciliaria
(v. Nutrición parenteral, cap. 1), con mayor frecuencia tras resección total o subtotal del intestino, es preciso evitar las deficiencias de vitaminas y oligoelementos. El médico debe asegurarse de que se suministran en cantidad suficiente biotina, vitamina K, selenio, molibdeno, manganeso y cinc.
Dietas vegetarianas: La forma más frecuente de vegetarianismo es el ovolácteo, en el cual se excluyen la carne y el pescado pero se consumen huevos y productos lácteos. El único riesgo es la deficiencia de hierro. Los ovolactovegetarianos tienden a vivir más tiempo y a desarrollar menos patologías incaPacitantes crónicas que sus homólogos que comen carne. Sin embargo, su estilo de vida suele incluir ejercicio regular y abstención de alcohol y tabaco, lo que puede contribuir a su mejor estado de salud. Los vegetarianos no consumen productos animales y son susceptibles a deficiencia de vitamina B12. Esta vitamina la proporcionan los extractos de levadura y los alimentos fermentados al estilo oriental. La ingesta de calcio, hierro y cinc también tiende a ser baja. Una dieta frugívora, que consiste únicamente en frutas, es deficiente en proteínas, sal y muchos micronutrientes y no es recomendable.
Dietas de moda: Muchas dietas comerciales anuncian un aumento de bienestar o una pérdida de peso. Los médicos deben estar en alerta ante la presencia temprana de una deficiencia o una toxicidad nutricional en los Pacientes que las siguen. Dietas de esa clase han dado por resultado estados manifiestos de deficiencia en vitaminas, minerales y proteínas y trastornos cardíacos, renales y metabólicos, así como algunas muertes. Las dietas muy bajas en calorías (<400 kcal/día) no pueden sostener la salud durante mucho tiempo. Algunos suplementos de oligoelementos indujeron toxicidad.
Dependencia de alcohol o drogas: Los Pacientes con problemas de alcohol o drogas son evidentemente poco fiables cuando se les pregunta por sus costumbres alimentarias; por ello puede ser imprescindible realizar las indagaciones pertinentes entre familiares y conocidos. La adicción lleva a una alteración del estilo de vida en la cual se descuida el mantenimiento de una alimentación suficiente. También se deteriora la absorción y el metabolismo de los nutrientes. Los altos niveles de alcohol son tóxicos y pueden causar lesión tisular, especialmente en tracto GI, hígado, páncreas, cerebro y sistema nervioso periférico. Los bebedores de cerveza que continúan consumiendo alimento pueden ganar peso, pero los al cohólicos que consumen 1 cuartillo de bebida fuerte por día pierden peso y llegan a estar hiponutridos. Los drogadictos suelen estar emaciados. El alcoholismo es la causa más frecuente de deficiencia de tiamina en Estados Unidos y puede llevar a deficiencias de magnesio, cinc y otras vitaminas (v. Deficiencia y dependencia de tiamina, cap. 3).

Diagnóstico
El diagnóstico de malnutrición se basa en los resultados de la historia médica y dietética, la exploración física y en pruebas de laboratorio seleccionadas (v. Valoración del estado nutricional, cap. 1). Los resultados se comparan con la normalidad del peso para la estatura, el índice de masa corporal (IMC), la ingesta dietética, los hallazgos físicos y los niveles plasmáticos de nutrientes y sustancias dependientes de nutrientes, como hemoglobina, hormonas tiroideas, transferrina y albúmina.
Historia: Una historia de apetito escaso, perturbación GI y pérdida de peso reciente considerable indica la posibilidad de malnutrición. Una historia de hemorragia puede indicar deficiencia de hierro. El consumo crónico de alcohol, cocaína, heroína, inmunosupresores o ciertos antibióticos y anticonvulsivos suscita dudas sobre la suficiencia de la nutrición vitamínica y mineral. Una historia dietética puede revelar la ingesta caprichosa de alimentos, ausencia de variedad o ingesta insuficiente o excesiva de energía y nutrientes esenciales.
Exploración física: Los cambios importantes en la composición del organismo y la función de los órganos pueden apuntar a la malnutrición como causa. Debe examinarse la piel en busca de sequedad, descamación, atrofia, petequias y equimosis, y la boca en busca de estomatitis angular, glositis, encías hinchadas o sangrantes y dientes perdidos. La despigmentación del cabello y las uñas en forma de cuchara indican malnutrición. Se debe examinar el tamaño, la fuerza y la sensibilidad al dolor de la musculatura. Una exploración neurobiológica puede detectar desorientación, una marcha anormal, reflejos alterados y anomalías de las neuronas sensitivas o motoras. Huesos y articulaciones dolorosos, osteopenia y distorsiones en la forma o el tamaño de los huesos (p. ej., rosario raquítico) pueden indicar malnutrición actual o pasada.
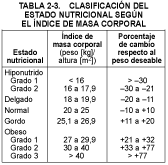
Las medidas antropométricas son esenciales para el diagnóstico. La tabla 1-5 enumera los intervalos de peso corporal deseable, con un peso umbral para la obesidad (20% por encima del peso deseable promedio). El estado nutricional se puede clasificar en función del IMC (v. tabla 2-3). El pliegue cutáneo en el tríceps (PCT) calcula la cantidad de grasa corporal en un 20% y, por tanto, es útil para determinar los depósitos de energía corporales. Basada en el área muscular en la mitad del brazo, una medida aproximada de la masa corporal magra, la masa muscular puede clasificarse en apropiada, marginal, deplecionada o atrofiada (v. tabla 2-4).

Pruebas de laboratorio: Un hemograma completo y la determinación de ciertas proteínas plasmáticas pueden reflejar la suficiencia de la nutrición de aminoácidos (albúmina, prealbúmina y transferrina), ayudan en el diagnóstico de malnutrición y, asimismo, en la determinación de los lípidos plasmáticos y las lipoproteínas emparentadas (v. tabla 1-6). Los niveles electrolíticos anormales pueden indicar una deficiencia de minerales o un defecto en la homeostasia iónica. Pueden determinarse las vitaminas liposolubles e hidrosolubles en plasma y orina. Las pruebas cutáneas que emplean antígenos se usan para evaluar la inmunidad mediada por células. Pueden ser útiles varias técnicas de imagen (rayos X, TC y RM).
Los procedimientos quirúrgicos suponen un estrés adicional en las personas hiponutridas. Se han empleado indicadores de malnutrición para elaborar un índice nutricional pronóstico (INP), un modelo predictivo lineal del aumento de morbididad y mortalidad tras los procedimientos quirúrgicos. La fórmula para el INP utiliza la albúmina sérica (A) en g/dl, el PCT en mm, la transferrina sérica (TFN) en mg/dl y la respuesta de hipersensibilidad retardada (DH) (0 a 2) medida por pruebas de inhibición de la migración, transformación y citotoxicidad de los leucocitos.
INP % = 158 - 16,6 (A) - 0,78 (PCT) - 0,2 (TNF) - 5,8 (DH)
Por ejemplo, un Paciente bien nutrido con A = 4,8, PCT = 14, TFN = 250 y DH = 2 tiene un INP de 158,0 - 152,2, o una probabilidad de complicaciones de 5,8%. Un Paciente malnutrido con índices anormales (A = 2,8, PCT = 9, TFN = 180 y DH = 1) tiene un INP de 158 - 95,3, o una probabilidad de complicaciones del 62,7%.
INANICIÓN
Modificaciones estructurales y funcionales debidas a una ausencia total de ingestión de fuentes energéticas y nutrientes esenciales.
La inanición es la forma más grave de malnutrición. Puede ser el resultado de ayuno, hambruna, anorexia nerviosa y enfermedad grave del tracto GI, ictus o coma. La respuesta metabólica principal a la inanición es la conservación de la energía y los tejidos corporales. No obstante, el organismo movilizará sus propios tejidos como fuente de energía, lo cual conduce a la destrucción de órganos viscerales y músculos y a una reducción extrema del tejido adiposo. La inanición total es mortal en 8 a 12 semanas.
Síntomas y signos
En adultos voluntarios que ayunaron durante 30 a 40 días, la pérdida de peso fue intensa (25% del peso inicial), la velocidad del metabolismo disminuyó y la velocidad y la cantidad de degradación de proteínas tisulares se redujo en un 30%. En una inanición más prolongada, la pérdida de peso puede llegar a un 50% en adultos e incluso más en niños. La pérdida de peso de los órganos es máxima en hígado e intestino, moderada en corazón y riñones, y mínima en el sistema nervioso. La emaciación es más evidente en los lugares donde existen normalmente los depósitos de grasa más notables. La masa muscular se reduce y se destacan los huesos. La piel se vuelve delgada, seca, sin elasticidad, pálida y fría. El cabello es seco y escaso y cae con facilidad.
Están afectados la mayoría de los sistemas del organismo. Son frecuentes la aclorhidria y la diarrea. El tamaño del corazón y el gasto cardíaco se reducen, el pulso es más lento y la tensión arterial cae. La frecuencia respiratoria y la capacidad vital disminuyen. El principal trastorno endocrino es la atrofia gonadal con pérdida de la libido en hombres y mujeres y amenorrea en éstas. La inteligencia se conserva clara, pero son constantes la apatía y la irritabilidad. El Paciente se siente agotado. La capacidad de trabajo está disminuida por la destrucción muscular y, con el tiempo, empeora por insuficiencia cardiorrespiratoria. La anemia suele ser leve, normocrómica o normocítica. La disminución de la temperatura corporal contribuye frecuentemente a la muerte. En el edema de la hambruna, las proteínas séricas suelen ser normales, pero la pérdida de grasa y músculo produce
aumento del agua extracelular, tensión tisular baja y pérdida de elasticidad de la piel. La inmunidad mediada por células está comprometida y la cicatrización de las heridas, perturbada (v. Inmunodeficiencia relacionada con la malnutrición, cap. 147).
Datos de laboratorio
Los niveles de ácidos grasos libres ascienden cuando se libera grasa del tejido adiposo para proporcionar energía. La glucemia desciende y se mantiene en un nivel más bajo por la síntesis de glucosa en el hígado a partir de los aminoácidos liberados en el músculo. Los niveles plasmáticos de aminoácidos aumentan al principio cuando el músculo es degradado, pero después caen cuando avanza la inanición, disminuyendo más los aminoácidos esenciales que los no esenciales. La insulina plasmática está baja, y el glucagón plasmático es alto; la albúmina sérica está casi normal mientras existe degradación muscular para suministrar aminoácidos para la síntesis de proteínas en el hígado. En términos generales, el catabolismo proteico disminuye durante la inanición, lo que se refleja en una reducción de la urea y el nitrógeno urinario total.
Tratamiento
Inicialmente la ingesta de alimentos debe limitarse hasta que esté restablecida la función GI. En adultos, la alimentación debe ser blanda, y las tomas de líquido deben limitarse al principio a unos 100 ml para evitar la diarrea. Se recomienda una fórmula que consiste en 42% de leche descremada en polvo, 32% de aceite comestible y 25% de sacarosa más electrólitos, minerales y suplementos vitamínicos. En ausencia de signos de deficiencia de micronutrientes específicos, éstos deben suministrarse en cantidades aproximadamente dobles de las cantidades dietéticas recomendadas (CDR), enumeradas en la tabla 1-3. Para el tratamiento de deficiencias específicas, véanse los capítulos 3 y 4. La ingesta de alimento se aumenta gradualmente hasta alcanzar unas 5.000 kcal/día y una ganancia de peso semanal de 1,5 a 2,0 kg.
Si la diarrea persiste en ausencia de infección, se puede sospechar una intolerancia a la lactosa. El yogur, en el que la lactosa está parcialmente hidrolizada a glucosa y galactosa, se tolera bien. Los Pacientes que no responden pueden necesitar alimentación por sonda nasogástrica, y la nutrición parenteral está indicada si la malabsorción es intensa (v. Nutrición parenteral, cap. 1).
Para corregir las deficiencias, que suelen ser múltiples, es precisa una instrucción dietética detallada, y no solamente la prescripción de una dieta equilibrada. A medida que el Paciente recupera peso, los desequilibrios de la ingesta de vitaminas y oligoelementos pueden conducir a síntomas clínicos de una enfermedad carencial. Para evitar esos problemas, el Paciente debería continuar tomando micronutrientes en cantidades aproximadamente dobles de las CDR hasta que la recuperación sea completa.
MALNUTRICIÓN PROTEICOENERGÉTICA
Síndrome de deficiencia causado por una ingesta insuficiente de macronutrientes.
La malnutrición proteicoenergética (MPE), o malnutrición proteicocalórica, se caracteriza no sólo por un déficit de energía debido a la reducción de todos los macronutrientes, sino también por un déficit de muchos micronutrientes. Este síndrome es un ejemplo de los diversos niveles de ingesta proteica y/o energética insuficiente entre la inanición (ingestión nula de alimentos) y la alimentación suficiente. Aunque los lactantes y los niños de algunas naciones en vías de desarrollo ejemplifican dramáticamente este tipo de malnutrición, puede ocurrir en personas de todas las edades en cualquier país.
Clasificación y etiología
La malnutrición proteicoenergética (MPE) tiene tres formas en la clínica: seca (delgada, deshidratada), húmeda (edematosa, hinchada) y una forma combinada entre los dos extremos. La forma clínica depende del equilibrio de fuentes de energía no proteicas y proteicas. Cada una de las tres formas puede graduarse como leve, moderada o grave. El grado se determina calculando el peso como porcentaje del peso esperado para la estatura usando estándares internacionales (normal, 90 a 110%; MPE leve, 85 a 90%; moderada, 75 a 85%; grave, <75%).
La forma seca, el marasmo, es el resultado de una inanición casi total con deficiencia de nutrientes proteicos y no proteicos. El niño marásmico consume muy poco alimento -a menudo porque su madre no puede criarlo con lactancia natural- y está muy delgado por la pérdida de músculo y grasa corporal.
La forma húmeda se denomina kwashiorkor, una palabra africana que significa «primer hijo-segundo hijo». Describe la observación de que el primer hijo desarrolla MPE cuando el segundo hijo nace y reemplaza al primero en el pecho. El niño destetado es alimentado con unas gachas diluidas de baja calidad nutricional (comparadas con la leche materna) y deja de desarrollarse. La deficiencia proteica suele ser más marcada que la deficiencia energética, y se produce edema. Los niños con kwashiorkor tienden a tener mayor edad que los que padecen marasmo y suelen desarrollar la enfermedad después del destete.
La forma combinada de MPE se denomina kwashiorkor marásmico. Los niños con esta forma clínica tienen algo más de edema y de grasa corporal que los que padecen marasmo.
Epidemiología
El marasmo es la forma predominante de MPE en la mayoría de los países en vías de desarrollo. Se asocia al abandono temprano o al fracaso de la lactancia materna y a las consiguientes infecciones, muy en especial a las que causan gastroenteritis infantil. Estas infecciones se producen debido a la falta de higiene e información sobre alimentación de lactantes.
El kwashiorkor es menos común y suele manifestarse como kwashiorkor marásmico. Tiende a estar confinado a zonas del mundo (África rural, islas del Caribe y el Pacífico) donde los alimentos básicos y los que se usan en el destete, como batata, mandioca, patata dulce y banana verde, son deficientes en proteínas y excesivamente ricos en almidón.
Fisiopatología
En el marasmo, la ingesta energética es insuficiente para las necesidades corporales y el organismo las cubre con sus propias reservas. El glucógeno hepático se agota en pocas horas, y las proteínas del músculo esquelético se usan a continuación en la vía de la gluconeogénesis para mantener una glucosa plasmática suficiente. Al mismo tiempo, los triglicéridos de los depósitos grasos son degradados a ácidos grasos, lo cual proporciona alguna energía para la mayoría de los tejidos, pero no al sistema nervioso. Cuando el estado de inanición casi total se prolonga, los ácidos grasos se oxidan incompletamente a cuerpos cetónicos, que pueden ser utilizados por el cerebro y otros órganos para obtener energía. Por ello, en la intensa deficiencia energética del marasmo, la adaptación es facilitada por los niveles altos de cortisol y hormona de crecimiento y por la depresión de insulina y hormonas tiroideas. Al movilizarse los aminoácidos a partir del músculo para proveer al hígado de sustratos para la síntesis proteica, los niveles plasmáticos de proteínas disminuyen menos en el marasmo que en el kwashiorkor.
En el kwashiorkor, la elevada ingesta relativa de hidratos de carbono con una ingesta proteica reducida conduce a una disminución de la síntesis de proteínas por las vísceras. La hipoalbuminemia resultante causa edema en partes declives, y el deterioro de la síntesis de ß-lipoproteínas origina esteatosis hepática. La secreción de insulina está estimulada al principio pero se reduce después en la enfermedad. La movilización de grasas y la liberación de aminoácidos a partir del músculo se reducen, por lo que el hígado dispone de menos sustrato de aminoácidos. En el marasmo y en el kwashiorkor, la respuesta insulínica a la carga de glucosa es escasa, posiblemente a causa de una deficiencia de cromo (v. Cromo, cap. 4).
La síntesis proteica total del organismo es de unos 300 g/día o 5 g/kg/día en el varón adulto medio. La pérdida obligada diaria es sólo de unos 60 a 75 g (9 a 12 g de nitrógeno), porque del 75 al 80% se reutiliza. La CDR de proteínas en el adulto es de unos 0,8 g/kg; lactantes y niños necesitan 1 a 2 g/kg/día (v. tabla 1-3). Así pues, los lactantes necesitan una proporción de aminoácidos esenciales en su dieta mayor que los adultos (v. tabla 1-1).
En la deficiencia proteica ocurren cambios enzimáticos adaptativos, las aminoácido-sintetasas aumentan y la formación de urea disminuye, conservando así el nitrógeno y reduciendo su pérdida en orina. Los mecanismos homeostáticos actúan inicialmente manteniendo el nivel de albúmina plasmática y otras proteínas transportadoras. La tasa de síntesis de albúmina disminuye finalmente, y los niveles plasmáticos descienden produciendo reducción de la presión oncótica y edema. En la deficiencia proteica grave se altera el crecimiento, la respuesta inmunitaria, la reparación tisular y la producción de algunas enzimas y hormonas.
Síntomas y signos
Los lactantes marásmicos tienen hambre, una importante pérdida de peso, retraso del crecimiento y atrofia de la grasa subcutánea y de los músculos. El kwashiorkor se caracteriza por edema generalizado; dermatosis «escamosa»; adelgazamiento, decoloración y enrojecimiento del cabello; hígado graso agrandado, y apatía irritable además de retraso del crecimiento. Los episodios alternantes de hiponutrición y alimentación suficiente pueden causar que el cabello tenga un espectacular aspecto de «bandera en franjas». Casi invariablemente se presentan infecciones en todas las formas de MPE, con diversas bacterias productoras de neumonía, diarrea, otitis media, enfermedad genitourinaria y sepsis. La infección se presenta a causa de una inmunidad deprimida que se parece en parte al SIDA, debido a la infección por el VIH. Sin embargo, a diferencia del defecto inmunitario del SIDA, el defecto en la malnutrición primaria puede revertirse con el tratamiento nutricional.
Datos de laboratorio
La MPE leve o moderadamente grave puede causar una ligera depresión de la albúmina plasmática y una menor excreción urinaria de urea, debida a la disminución de la ingesta proteica, y de la hidroxiprolina, lo que refleja un deterioro del crecimiento. El aumento de 3-metilhistidina urinaria refleja la degradación muscular. En el marasmo y el kwashiorkor, los porcentajes de agua corporal y de agua extracelular están aumentados. Los electrólitos, en especial potasio y magnesio, están deplecionados, los niveles de algunas enzimas y lípidos circulantes son bajos, y la urea sanguínea disminuye. También existe anemia, que suele deberse a deficiencia de hierro, y acidosis metabólica. Es común la diarrea, a veces agravada por deficiencia de disacaridasas intestinales, en especial lactasa.
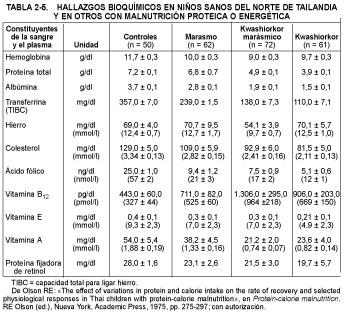
El kwashiorkor se caracteriza por niveles bajos de albúmina plasmática (10 a 25 g/l), transferrina, aminoácidos esenciales (especialmente los de cadena ramificada), ß-lipoproteínas y glucosa. Los niveles plasmáticos de cortisol y hormona de crecimiento son altos, pero la secreción de insulina y el factor de crecimiento análogo a la insulina están disminuidos. Como ejemplo se muestran en la tabla 2-5 los datos bioquímicos en niños sanos del norte de Tailandia y en niños con MPE.
Diagnóstico
El diagnóstico diferencial incluye la consideración del fracaso del crecimiento secundario a malabsorción, defectos congénitos, insuficiencia renal, enfermedad endocrina o privación emocional. Los cambios cutáneos en el kwashiorkor difieren de los de la pelagra, en la cual aparecen en la piel expuesta a la luz y son simétricos. El edema de la nefritis, la nefrosis y la insuficiencia cardíaca va acompañado con otros rasgos de estas enfermedades y responden al tratamiento específico. Puede diferenciarse la hepatomegalia por trastornos del metabolismo del glucógeno y la fibrosis quística.
Tratamiento
En niños y adultos con MPE grave, el primer paso es corregir las anomalías de líquidos y electrólitos y tratar las infecciones con antibióticos. Las anomalías electrolíticas más comunes son la hipopotasemia, la hipocalcemia, la hipofosfatemia y la hipomagnesemia. El segundo paso, que puede retrasarse de 24 a 48 horas en los niños (para evitar el empeoramiento de la diarrea), es proporcionar macronutrientes como tratamiento dietético. Las fórmulas basadas en la leche son el tratamiento de elección. La cantidad se aumenta gradualmente durante la primera semana; tras una semana se puede administrar la dieta completa de 175 kcal/g y 4 g de proteína/kg para los niños y 60 kcal/kg y 2 g de proteína/kg para los adultos.
Tratamiento con líquidos y electrólitos: Al principio, los niños con MPE deben ser tratados con líquidos i.v. Aunque el agua corporal total está aumentada, suelen existir pruebas de deshidratación intravascular, especialmente en niños con historia de diarrea intensa. El líquido de rehidratación inicial es la solución de Darrow, que contiene 1:2:3 partes por volumen de lactato 0,17 M: solución salina fisiológica: glucosa 5%, a la cual se añaden 50 ml de solución de dextrosa al 50% por cada 500 ml. Esta solución aporta 78 mEq/l de sodio y 55 mM/l de glucosa. El déficit de agua debe reemplazarse a lo largo de las primeras 8 a 12 horas de tratamiento. Por ejemplo, un niño de 5 kg con una deshidratación del 10% debería recibir un total de 500 ml de líquido a lo largo de 12 h.
Pasadas las primeras 12 h, puede añadirse potasio a la infusión hasta alcanzar una concentración de 20 mM/l. Un niño gravemente deshidratado puede recibir hasta 20 ml/kg de la solución i.v. inicial (2% del peso corporal) durante la primera hora de tratamiento para aumentar el volumen intravascular y por tanto el flujo sanguíneo renal y la diuresis. Al segundo día, si el niño no puede ser alimentado por vía oral, o tiene diarrea persistente, se administra por vía i.v. solución de lactato: solución salina fisiológica: glucosa en proporción 1:2:6 que contiene 20 mEq/l de potasio a una tasa de 10 ml/kg/h hasta que inicie el tratamiento oral, habitualmente al tercer día. Por vía i.m. se administra un suplemento de magnesio de 0,4 mEq/kg/día durante 7 días. En los 3 primeros días se administran vitaminas del complejo B por vía parenteral a dos veces la CDR (v. tabla 1-3).
Para la rehidratación oral en los adultos es satisfactoria la solución de la Organización Mundial de la Salud que contiene 90 mEq/l de sodio,
20 mEq/l de potasio, 80 mEq/l de cloruro, 30 mEq/l de bicarbonato y 111 mM/l de glucosa, administrada en dosis repartidas a lo largo de 24 h.
Tratamiento dietético: Cuando la diarrea es grave, se puede mantener al Paciente en dieta absoluta (nada por vía oral) hasta 48 h. Cuando la diarrea remite (habitualmente durante las primeras 48 h), la vía intravenosa se suspende y se empieza la alimentación oral.
En las etapas tempranas de la MPE, es más fácil administrar las calorías y proteínas necesarias con una fórmula basada en la leche, que puede administrarse por sonda si es imprescindible. Un producto de leche entera en polvo puede enriquecerse con aceite de germen de trigo y maltodextrina de modo que contenga 100 kcal, 4 g de proteínas, 5,5 g de grasas y 8,2 g de hidratos de carbono por cada 100 ml. La distribución de la energía entre los macronutrientes es de 16% de proteínas, 50% de grasa y 34% de hidratos de carbono. Esta fórmula suministra también 2,7 mEq/kg de sodio, 5 mEq/kg de potasio, 7,3 mEq/kg de calcio, 6,2 mEq/kg de fósforo y 1,4 mEq/kg de magnesio por día. Es enriquecido para satisfacer las necesidades del niño de cinc, manganeso, cobre, yodo, flúor, molibdeno y selenio. Tras 4 semanas, la fórmula puede reemplazarse por leche completa más alimentos sólidos, incluidos huevos, fruta, carnes, aceite de hígado de pescado y levadura.
Un grupo de niños tailandeses con MPE fueron alimentados ad libitum durante un período de 12 semanas. Alcanzaron su ingesta máxima de 165 kcal/kg y 6 g de proteínas/kg y su máxima tasa de crecimiento después de 3 semanas de tratamiento. Su ingesta decreció después lentamente a 125 kcal/kg y 4 g de proteínas/kg a las 12 semanas. En ese momento habían alcanzado el 90% del peso esperado según la estatura. El hierro es importante en el tratamiento de los niños con MPE. La mayoría tienen reducidos sus depósitos de hierro en la médula ósea al ingreso, y, si no se administra un suplemento de hierro, todo el contenido en la médula ósea desaparece en 4 a 6 semanas. Dado que la absorción oral de hierro es escasa en la MPE, debe considerarse el uso i.m. o de altas dosis de hierro oral (100 a 200 mg/día de hierro elemento). El hierro i.m. incrementa inmediatamente los depósitos de hierro en la médula ósea. En los adultos con MPE, la anemia leve puede tratarse con hierro oral.
La mayoría de los adultos con MPE pueden tomar la fórmula por boca desde el principio. Para tratar la repleción se puede utilizar una fórmula comercial para la alimentación oral (v. tabla 1-8).
Pronóstico
La mortalidad varía en los niños entre el 5 y el 40%. Las tasas de mortalidad más bajas se observan en niños que recibieron asistencia intensiva. La muerte en los primeros días de tratamiento suele deberse a desequilibrio electrolítico, infección con sepsis, hipotermia o insuficiencia cardíaca. El estupor, la ictericia, las petequias, los niveles de sodio bajos y la diarrea persistente son signos desfavorables. La desaparición de la apatía, el edema y la anorexia es un signo favorable. La recuperación es más rápida en el kwashiorkor que en el marasmo.
No están documentados del todo los efectos a largo plazo de la malnutrición en la infancia. Cuando el tratamiento es suficiente, el hígado se recupera completamente sin cirrosis subsiguiente. En algunos niños persiste la malabsorción y la deficiencia pancreática. La inmunidad humoral está deteriorada de un modo variable y la inmunocompetencia mediada por células está notablemente comprometida, pero ambas vuelven a la normalidad tras el tratamiento. El grado de deterioro mental es proporcional a la duración, la gravedad y la edad de comienzo de la malnutrición. Algunos estudios prospectivos señalan que puede persistir un grado relativamente leve de retraso mental hasta la edad escolar.
En los adultos, la MPE no tratada puede producir morbididad y alguna mortalidad, pero los datos de mortalidad son escasos. Excepto cuando se produce fracaso de órganos, el tratamiento es siempre exitoso.
DEFICIENCIA DE CARNITINA
El aminoácido carnitina es un derivado metilado y después modificado de la lisina; es necesario para el transporte de los acilésteres de ácidos grasos de cadena larga con la coenzima A (CoA) al interior de las mitocondrias. La carnitina palmitoiltransferasa cataliza la transesterificación del grupo acilo graso desde la CoA hacia la carnitina, la cual es transportada después a través de la membrana interna de la mitocondria. Una segunda transesterificación dentro de la mitocondria regenera el acilo graso de la CoA para la ß-oxidación.
Los alimentos de origen animal son ricos en carnitina porque las células animales pueden sintetizarla. Los requerimientos humanos de carnitina se satisfacen por tanto mediante una combinación de biosíntesis endógena e ingesta dietética. Una dieta ordinaria aporta alrededor de 100 a 300 mg/día, y la biosíntesis contribuye con 300 a 600 mg/día. La deficiencia de carnitina puede causar necrosis muscular, mioglobinuria, miopatía por almacenamiento de lípidos, hipoglucemia, hígado graso e hiperamoniemia con molestias musculares, fatiga y confusión.
La deficiencia de carnitina puede ser el resultado de una capacidad reducida para su síntesis; niveles de carnitina palmitoiltransferasa inferiores a los normales; alteración de los mecanismos celulares para el transporte de carnitina; exceso de pérdida de carnitina debido a diarrea, diuresis o hemodiálisis; aumento de las necesidades de carnitina en estados de cetosis y alta demanda de
ß-oxidación, e ingesta insuficiente en la NPT. Algunas deficiencias son resultado de mutaciones en las enzimas necesarias para la biosíntesis, el transporte o el metabolismo de la carnitina (p. ej., deficiencia de carnitina palmitoiltransferasa, aciduria metilmalónica, acidemia propiónica y acidemia isovalérica), y pueden corregirse administrando L-carnitina, 25 mg/kg v.o. cada 6 horas. La disminución de la síntesis causada por una hepatopatía grave puede reducir los niveles de carnitina en el organismo, también lo puede hacer la pérdida excesiva debida a diálisis en la insuficiencia renal crónica. El tratamiento con carnitina revierte la hipoglucemia y la debilidad del músculo esquelético, asociadas con la evidencia bioquímica de deficiencia de carnitina durante la NPT prolongada.
DEFICIENCIA DE ÁCIDOS GRASOS ESENCIALES
Son ácidos grasos esenciales (AGE) los ácidos linoleico y araquidónico, que son ácidos grasos w-6 (n-6), y el ácido linolénico, el ácido eicosapentaenoico y el ácido docosahexaenoico, que son ácidos grasos w-3 (n-3) (v. también cap. 1). En el organismo, el ácido araquidónico puede producirse a partir de ácido linoleico, y los ácidos eicosapentaenoico y docosahexaenoico pueden producirse a partir de ácido linolénico. Los aceites vegetales, como aceite de trigo, aceite de semilla de algodón y aceite de haba de soja, son fuentes de los ácidos linoleico y linolénico; los aceites de pescado son fuentes de los ácidos eicosapentaenoico y docosahexaenoico. Las necesidades de AGE son del 1 al 2% de las calorías dietéticas para los adultos y del 3% para los lactantes, proponiéndose una proporción de 10:1 para los ácidos grasos w-6:w-3.
Los AGE son imprescindibles para muchos procesos fisiológicos, entre ellos mantener la integridad de la piel y la estructura de las membranas celulares y sintetizar prostaglandinas y leucotrienos. Los ácidos eicosapentaenoico y docosahexaenoico son importantes componentes del encéfalo y la retina.
Los recién nacidos alimentados con fórmulas de leche descremada pobres en ácido linoleico pueden tener retraso del crecimiento, trombocitopenia, alopecia y una dermatitis descamativa que se parece a la ictiosis congénita, con aumento de pérdida de agua por la piel. Este síndrome se revierte mediante el suplemento de ácido linoleico. Es improbable que la deficiencia se presente con dietas equilibradas, aunque la leche de vaca tiene sólo alrededor del 25% de la cantidad de ácido linoleico presente en la leche humana. Aunque la ingesta grasa total en muchos países en desarrollo es muy baja, la mayor parte de la grasa es de origen vegetal y es rica en ácido linoleico con algo de ácido linolénico.
La deficiencia de AGE representa un peligro en la NPT prolongada libre de grasas, pero las emulsiones grasas que actualmente se usan de modo generalizado la evitan (v. Nutrición parenteral, cap. 1). Un ejemplo es la emulsión de aceite de soja al 10% que contiene unos 56 g/l de ácido linoleico y 8 g/l de ácido linolénico. Se ha comunicado un solo caso de deficiencia de ácido linolénico, caracterizada por una neuropatía periférica y visión borrosa en una niña de 6 años de edad con síndrome de intestino corto después de 9 meses de tratamiento con una preparación i.v. de lípidos que contenía 77 g de linoleato y sólo 0,1 g de ácido linolénico/l. Los síntomas y signos se corrigieron mediante suplementos de ácido linolénico.
En la deficiencia de AGE temprana, los niveles plasmáticos de los ácidos linoleico y araquidónico son bajos, y está presente el ácido 5,8,11-eicosatrienoico, un subproducto anormal de la desaturación del ácido oleico. Se ha propuesto un límite normal superior de 0,2 para el cociente entre ácido eicosatrienoico y ácido eicosatetraenoico (araquidónico) en el plasma. La demostración de la deficiencia de AGE basada en este cociente se ha observado en Pacientes con malabsorción de grasas, traumatismos graves y quemaduras.
La deficiencia de AGE representa un peligro en la NPT prolongada libre de grasas, pero las emulsiones grasas que actualmente se usan de modo generalizado la evitan (v. Nutrición parenteral, cap. 1). Un ejemplo es la emulsión de aceite de soja al 10% que contiene unos 56 g/l de ácido linoleico y 8 g/l de ácido linolénico. Se ha comunicado un solo caso de deficiencia de ácido linolénico, caracterizada por una neuropatía periférica y visión borrosa en una niña de 6 años de edad con síndrome de intestino corto después de 9 meses de tratamiento con una preparación i.v. de lípidos que contenía 77 g de linoleato y sólo 0,1 g de ácido linolénico/l. Los síntomas y signos se corrigieron mediante suplementos de ácido linolénico.